FLAG亲和标签:提升重组蛋白研究效率的关键技术
在重组蛋白表达和纯化过程中,为了便于纯化和检测,通常会在目的蛋白上添加亲和标签(affinity tag)。其中,FLAG (DYKDDDDK, DDDDK等)标签是常用的,因为这些标签的表达载体是广泛可用的。

- 最新进展
- 产品信息
- 参考文献
最新进展
在重组蛋白表达和纯化过程中,为了便于纯化和检测,通常会在目的蛋白上添加亲和标签(affinity tag)。其中,FLAG (DYKDDDDK, DDDDK等)标签是常用的,因为这些标签的表达载体是广泛可用的。
一、Flag 融合标签的独特结构
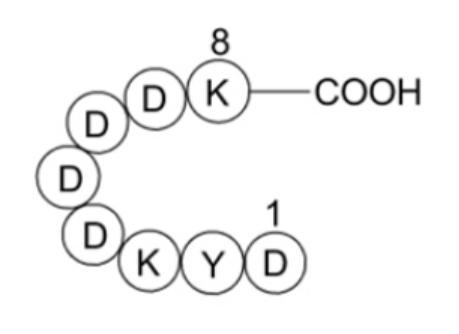
Flag 融合标签由八个氨基酸(DYKDDDDK)组成,看似简单却蕴含着精妙的设计。其结构短小精悍,这一特点为后续的编码和操作带来极大便利。在这个八肽序列中,芳香族氨基酸发挥着关键作用,它们是抗原 - 抗体相互作用的主要参与者。序列中的第二个氨基酸 Tyr 尤为重要,其左侧与带负电的 Asp 相连,这种组合增强了 Tyr 的抗原性。而 Tyr 下游的六个氨基酸(Lys - Asp - Asp - Asp - Asp - Lys)形成了高度亲水的序列,该序列能够塑造出高度暴露的三维蛋白质构型,从而展现出强大的抗原性。正是这种独特的结构,使得 Flag 短肽能够高效地发挥蛋白质标签的功能。
二、Flag 融合标签的显著优势
1.编码简易
仅由八个氨基酸构成的 Flag 序列,编码时只需一条人工合成的寡核苷酸链即可完成。相比其他复杂的标签,这种简易的编码方式大大降低了实验成本和操作难度,提高了实验效率,为科研人员节省了大量的时间和精力。
2.切割位点灵活
Flag 标签含有肠激酶切割位点,肠激酶能够精准识别短肽 C 端的五个氨基酸(DDDDK)。通过肠激酶处理,科研人员可以轻松除去标签,获得天然的非融合蛋白质,这对于需要研究蛋白质天然结构和功能的实验至关重要,确保了实验结果的准确性和可靠性。
3.融合位置多样
Flag 抗原标签的融合位置十分灵活,可以被融合到目的蛋白质的 N 端或 C 端。研究表明,融合在 N 端的 FLAG 序列稳定性良好,在大肠杆菌等表达系统中不会被蛋白酶轻易除去,并且在酵母和大肠杆菌中的表达性质相似。此外,当目的蛋白 N 端融合了 Flag 多肽后,C 末端还能继续融合其他模块或不同的亲和配体,为蛋白质的多功能研究和应用提供了广阔空间。

三、精准去除 Flag 标签的方法
在蛋白研究过程中,有时需要去除 Flag 标签以获得纯净的目标蛋白。目前常用的标签切除方法主要包括两类:一是利用特异性蛋白酶进行酶切;二是在融合蛋白中引入蛋白内含肽系统。其中,蛋白酶切除法是应用最广泛的方法,常用的蛋白酶包括:肠激酶(enterokinase)、凝血酶、Xa因子、烟草蚀纹病毒蛋白酶(TEV)、genenaseⅠ和3C蛋白酶等,这些蛋白酶都能在融合标签与目的蛋白之间特定位点进行切割。
1. 肠激酶切除法:
肠激酶是去除N端Flag标签最常用的蛋白酶,能精确识别D-D-D-D-K五肽序列。其切割效率主要取决于赖氨酸(K)后的第一个氨基酸残基。Flag标签(DYKDDDDK)本身就含有肠激酶识别位点,酶切后可获得仅保留4个氨基酸残基的短肽标签。研究人员已成功克隆表达牛肠激酶催化亚基,该酶具有活性高、pH适应范围广等优点,且能在多种变性剂和去污剂条件下保持切割活性,切割产物不含多余氨基酸残基。
Hosfield等采用不依赖连接的克隆技术(LIC),在Flag标签与目的蛋白之间引入特定氨基酸残基(X),构建了-DYKDDDDK-X-R序列(R代表目的蛋白)。以钙调蛋白基因为模型,系统研究了X残基对酶切效率的影响。实验结果显示:当X为Lys、Ala、Leu、Ile、Phe、Glu、Met、Asp或Asn时,切割效率可达80%以上;而当X为Tyr或Pro时,由于空间位阻效应,切割效率会降至70%以下。这一发现对获得天然蛋白具有重要意义。因此,我们可以采用LIC技术将Flag标签直接连接目的基因,表达纯化后通过肠激酶切除标签,从而获得具有天然结构和功能的蛋白质。
2. 凝血酶切割
凝血酶也是一种应用广泛的蛋白酶,不过它在切割重组蛋白后,会在切割位点的 C 端保留两个氨基酸残基。凝血酶可以识别两种类型的氨基酸序列,对 X4 - X3 - P - P [K] - X1΄ - X2΄ 这种序列的识别效果更佳。在一些对蛋白质 C 端氨基酸序列要求不那么严格的实验中,凝血酶可作为去除 Flag 标签的选择之一。
3. Xa 因子切割
Xa 因子是一种高效的去除融合标签的工具酶,它能够特异性识别 I - E [D] - G - R - X1 序列,并从融合标签的 C 末端进行切除。在特定的实验条件和蛋白质结构下,Xa 因子能够发挥其高效切割的优势,为科研人员提供了另一种去除 Flag 标签的有效途径。
Flag 融合标签凭借其独特的结构、显著的优势、多样的抗体种类以及灵活的标签去除方法,在蛋白纯化与研究领域占据着重要地位。
产品信息
参考文献
[1] Hopp T P , Prickett K S , Price V L , et al. A Short Polypeptide MarkerSequence Useful for Recombinant Protein Identification and Purification[J].Nature Biotechnology, 1988, 6(10):1204-1210.
[2] Gloeckner C J, Boldt K,SehumacherA,et al. Tandem affinity purification of protein complexes from mammalian cellsby the Strep/FLAG (SF)-TAP tag[J]. Methods Mol Biol,2009,564, 359-372.
[3] Hopp T P , Woods K R . Prediction of protein antigenicdeterminants from amino acid sequences[J]. Proceedings of the National Academyof Sciences, 1981, 78(6):3824-3828.
[4] Babu M, Butland G, Pogoutse O, et al.Sequential peptide affinity purification system for the systematic isolationand identification of protein complexes from Escherichia coli [J]. Methods MolBiol,2009,564: 373-400.





